Obsah
- Počet elektrónov vo valenčnom plášti
- Krok 1
- Krok 2
- Krok 3
- Krok 4
- Lewisova štruktúra
- Krok 1
- Krok 2
- Krok 3
- Formálny náboj každého atómu
- Krok 1
- Krok 2
- Krok 3
Pri určovaní formálneho náboja molekuly, ako je CoCl2 (plynný fosgén), je potrebné poznať počet elektrónov vo valenčnej vrstve každého atómu a Lewisovu štruktúru molekuly.
Počet elektrónov vo valenčnom plášti
Krok 1
Vyhľadajte každý atóm v periodickej tabuľke prvkov a určte počet elektrónov vo valenčnom plášti.
Krok 2
Pamätajte, že dva elektróny sú na prvej podúrovni s, dva sú na druhej podúrovni s, šesť elektrónov na prvej podúrovni p atď. Pamätajte: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Krok 3
Narazte na záťaž. Ak je molekulou ión, pridajte alebo odčítajte jeden alebo viac elektrónov od celkového množstva, aby ste sa dostali k finálnemu náboju.
Krok 4
Pre CoCl2 (plynný fosgén): C = 4; O = 6; Cl = 7. Molekula nie je ionizovaná a má neutrálny náboj. Preto je celkový počet elektrónov vo valenčnom plášti 4 + 6 + (7x2) = 24.
Lewisova štruktúra
Krok 1
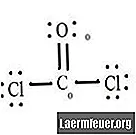
Pozri schému Lewisovej štruktúry CoCl2 (plynný fosgén). Lewisova štruktúra predstavuje najstabilnejšiu a najpravdepodobnejšiu štruktúru molekuly. Atómy sú ťahané spárovanými valenčnými elektrónmi; medzi voľnými elektrónmi sa vytvárajú väzby, aby vyhovovali pravidlu oktetu.
Krok 2

Nakreslite každý atóm a jeho valenčné elektróny a potom podľa potreby vytvorte väzby.
Krok 3
Atómy chloridu zdieľajú jednoduché väzby s molekulou uhlíka, zatiaľ čo atóm kyslíka vytvára s uhlíkom dvojitú väzbu. Každý atóm vo výslednej štruktúre spĺňa oktetové pravidlo a má osem elektrónov vo valenčnom obale, čo umožňuje molekulárnu stabilitu.
Formálny náboj každého atómu
Krok 1
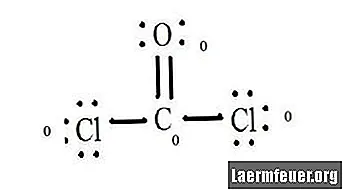
Spočítajte páry bez elektrónov každého atómu v Lewisovej štruktúre. Každý atóm má priradený elektrón z každej väzby, na ktorej sa zúčastňuje. Pridajte tieto čísla. V CoCl2: C = 0 voľných párov plus 4 elektróny väzieb = 4 elektróny. O = 4 elektróny voľných párov plus 2 elektróny väzieb = 6 elektrónov. Cl = 6 elektrónov voľných párov plus jeden elektrón väzby s C = 7 elektrónov.
Krok 2
Odpočítajte množstvo elektrónov vo valenčnom obale neviazaného atómu. Výsledkom je formálny náboj pre každý atóm. V CoCl2: C = 4 valenčné elektróny (ev) v nenaviazanom atóme mínus 4 elektróny určené v Lewisovej štruktúre (LS) = 0 formálneho náboja O = 6 ev - 6 LS = 0 formálneho náboja Cl = 7 ev - 7 LS = 0 formálny náklad
Krok 3
Pri písaní umiestnite tieto náboje do blízkosti atómov v Lewisovej štruktúre. Ak má molekula celkom náboj, umiestnite Lewisovu štruktúru do zátvoriek s nábojom napísaným zvonka v pravom hornom rohu.