
Obsah
Kataláza je enzým, ktorý sa nachádza v bunkách zvierat, rastlín a aeróbnych baktérií. Enzým je veľká molekula, syntetizovaná v bunkách a produkovaná ako katalyzátor v reakcii. Každý typ enzýmu vykonáva špecifickú funkciu a funkciou katalázy je konvertovať potenciálne škodlivý vedľajší produkt na prvky užitočné pre bunku.

funkcie
Kataláza, podobne ako väčšina enzýmov, je proteín. Nachádza sa v peroxizómoch, ktoré sú membránovými bunkovými organelami. Kataláza má dôležitú biologickú funkciu: katalyzuje rozklad peroxidu vodíka, látky toxickej pre organizmy, na vodu a molekulárny kyslík, ktoré sú neškodné a užitočné.

štruktúra
Činková štruktúra katalázy obsahuje štyri polypeptidové reťazce, z ktorých každý obsahuje viac ako 500 aminokyselín. Kataláza má tiež štyri skupiny hemu, ktoré sú vyrobené z protoporfyrínových kruhov obsahujúcich jeden atóm železa. Tieto prstence sú umiestnené v štyroch reťazcoch.
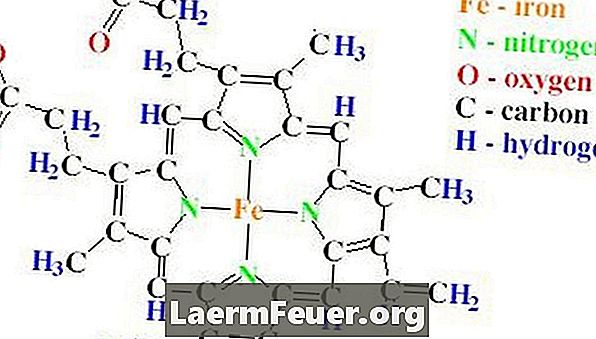
Význam katalázy
Peroxid vodíka je vedľajším produktom mnohých biologických funkcií organizmov. Všetky aeróbne organizmy používajú pri dýchaní kyslík. Redukcia kyslíka vo vode je často neúplná a je možné prenášať ďalší elektrón z kovového iónu, čo spôsobuje tvorbu peroxidu. Väčšina peroxidu vodíka sa však vytvára počas produkcie ATP v mitochondriách. Hoci peroxid vodíka je toxický pre živé bunky, reakcia na jeho rozpad späť na vodu a kyslík prebieha rýchlo a účinne. Kataláza je známa ako jeden z najúčinnejších enzýmov s obratom okolo 200 000 udalostí / sekundu / podjednotka. Bez katalázy na zvýšenie rýchlosti reakcií by peroxid vodíka zostal a poškodil by bunky.
Faktory ovplyvňujúce účinnosť katalázy
Katalázu a jej aktivitu mení niekoľko faktorov, vrátane teploty, pH, koncentrácie soli, množstva substrátu a prítomnosti inhibítorov alebo aktivátorov. Teplota je dôležitým faktorom vo všetkých biochemických reakciách, pretože vysoká teplota môže spôsobiť denaturáciu enzýmov. Keď sa enzým denaturuje, mení svoju konformáciu, čo spôsobuje, že substrát sa viaže menej efektívne, čím sa znižuje rýchlosť reakcie. Na druhej strane, kým sa nedosiahne maximálna teplota (ktorá je odlišná pre každý typ katalázy), rýchlosť reakcie sa bude zvyšovať spolu s teplotou. PH, miera kyslosti alebo koncentrácia iónov vodíka v roztoku, sa meria na stupnici od 0 do 14. Ako sa roztok stáva kyslejším (pod 7), enzým môže z roztoku získať vodíkový ión. a ako sa roztok stáva bázickejším (nad 7), môže stratiť ión vodíka. Každý z týchto extrémov môže znížiť rýchlosť reakcie, pretože katalázové chemické väzby sa menia. Existujú dva typy inhibítorov: nekompetitívne inhibítory, ktoré sa viažu na miesto, ktoré nie je aktívnym miestom, a kompetitívne inhibítory, ktoré sa viažu na aktívne miesto katalázy. Síran meďnatý je známy nekompetitívny inhibítor katalázy a kyanid je známy ako kompetitívny inhibítor. Vo všeobecnosti, ako sa zvyšuje množstvo peroxidu vodíka, rýchlosť reakcie sa tiež zvýši. Enzymatické reakcie sa však riadia Michaelovou-Mentenovou rovnicou, ktorá hovorí, že každá reakcia dosiahne bod nasýtenia, čo znamená, že pri maximálnej reakčnej rýchlosti už viac substrátu nebude mať účinok.
Iné použitia katalázy
Keďže kataláza je prítomná prakticky vo všetkých živých organizmoch, je jedným z najviac študovaných enzýmov. To viedlo vedcov k nájdeniu ďalších funkcií pre tento účinný enzým. Kataláza sa používa na ošetrenie vnútra plastov na balenie potravín. Zabraňuje oxidácii, a preto pomáha šetriť potraviny. Kataláza sa tiež používa počas procesu sterilizácie za studena, čo je spôsob konzervovania mlieka a syra pôsobením peroxidu vodíka. Tento enzým sa používa na odstránenie zvyšných stôp peroxidu vodíka.